Forschungs-Nachricht
Spermien sind einzigartig. Im Vergleich zu Sinnes-, Herz-, oder Nervenzellen verwenden Spermien oft spezielle Proteine, die in anderen Zelltypen nicht vorkommen. Mit Hilfe verschiedener physikalischer und chemischer Wegweiser navigieren Spermien zum Ei. Die Navigation wird durch biochemische Signalwege gesteuert. Erst in den letzten Jahren wurde erkannt, dass Moleküle, die uns aus somatischen Zellen - wie Riech- oder Sehzellen - bekannt sind, in Spermien keine Rolle spielen. Noch rätselhafter ist, dass die Signalmoleküle in Spermien wie bekannte Gesichter erscheinen - das heißt, ihre Aminosäuresequenz ist ähnlich der ihrer Verwandten in somatischen Zellen. Es ist jedoch eine "Maske" hinter der sich andere unerwartete Eigenschaften und Funktionen verbergen. Diese Maskerade hat große Verwirrung in der Reproduktionsforschung gestiftet.
Ein solches Molekül ist ein Natrium/Protonen-Austauscher (NHE) [1]. NHEs, die den pH-Wert in vielen Zellen regulieren, gehören zu einer großen Familie von Membranproteinen, die Ionen und Nährstoffe in und aus Zellen transportieren - vom einfachen Bakterium bis hin zum Menschen. Ionen passieren die Zellmembran in einem pas de deux: Der Fluss von Natriumionen in die Zelle ist mit dem Fluss von Protonen aus der Zelle heraus verbunden (Abbildung 1). Natriumionen binden an die Außenseite des Austauschermoleküls und Protonen binden an die Innenseite. Durch Hin-und-Her-Bewegungen wie bei einem Schaukelstuhl werden die Ionen kontinuierlich nach innen und außen transportiert. Dieser Schaukelstuhlmechanismus ist für den Transport von Ionen, Aminosäuren, Zuckern oder Fetten erhalten geblieben. Welcher Mechanismus löst die Schaukelbewegung aus? Es sind die Ionen selbst! Wenn sie an das Transportmolekül binden, verändern sie gleichzeitig dessen Struktur: Die Bindungsstellen bewegen sich auf und ab und tragen die Ionen wie in einem Aufzug mit sich durch die Zellmembran.
Obwohl der Natrium/Protonen-Austauscher in Spermien bereits 2003 entdeckt worden war, blieben seine Eigenschaften unbekannt, da das Gen in Zelllinien nicht funktionell exprimiert werden konnte und die Charakterisierung in Spermien technisch schwierig war. Das ist uns nun gelungen mit dem Austauscher aus Seeigel-Spermien. Der gating Mechanismus des NHE aus Spermien unterscheidet sich von anderen Austauscher-Molekülen. Der NHE hat zwei weitere Domänen, die aus Ionenkanälen bekannt sind: einen Spannungs-Sensor und eine Domäne, die zyklische Nukleotide bindet (Abbildung 2). Diese Beobachtung war sehr überraschend und zeigte, dass die zusätzlichen Domänen etwas mit dem gating zu tun haben.
Tatsächlich wird der Natrium/Protonen-Austauscher durch Änderungen der Membranspannung ein- und ausgeschaltet. Der aufregendste Befund war jedoch, dass wir die Rolle des zellulären Botenstoffs cAMP in Seeigelspermien aufdecken konnten. Es war seit fast 40 Jahren bekannt, dass cAMP irgendwie am Chemotaxis-Signalweg beteiligt ist; Die genaue Funktion konnte jedoch nicht entschlüsselt werden. Unsere Arbeit zeigt, dass cAMP das Austauscher-Molekül gegenüber Spannungssprüngen empfindlicher macht. Diese Sensibilisierung erinnert an den Herzschrittmacherkanal im Herzen und im Gehirn [2]. Im Wesentlichen ist der Austauscher eine Chimäre zwischen Transportern und Ionenkanälen. Eine der spannendsten Fragen ist: Wie kann ein Spannungssensor und eine cAMP-bindende Domäne zwei so verschiedene Mechanismen des Ionentransports steuern. Die Aufklärung der dreidimensionalen Architektur durch biologische Strukturforschung wird hoffentlich die Antwort darauf liefern, wie sich die Mechanismen des Ionentransports während der Evolution entwickelt haben.
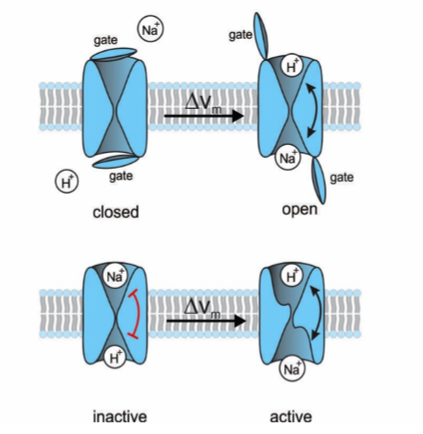
Abbildung 1: Vorschlag für zwei unterschiedliche gating Mechanismen des Na+/H+ Austauschers. (oben) Ein Deckel versperrt den Ionen den Zugang zu den jeweiligen Bindestellen. Ein Spannungssprung öffnet den Deckel; der Schaukelstuhl-Mechanismus ist jetzt möglich. (unten) Die Ionen-Bindestellen sind zugänglich, die Schaukelstuhl-Bewegung ist aber verriegelt (roter Balken). Der Spannungssprung entriegelt den Mechanismus.
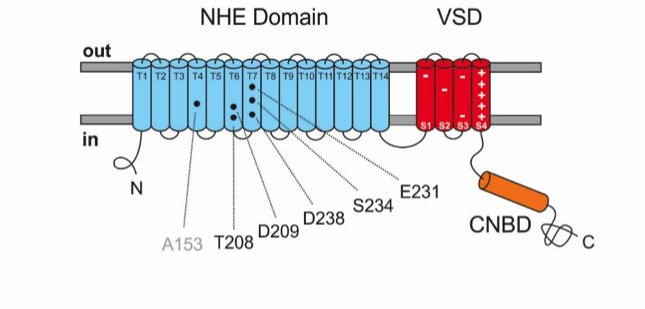
Abbildung 2: Schematische Darstellung der NHE-Topologie in der Zellmembran. Austauscher-Domäne (blau) zeigt die Aminosäuren (schwarz) der Na+-Bindestelle, die zwischen NHEs von Archaea und Spermien konserviert sind; transmembranale Segmente sind als T1-T14 gekennzeichnet; Spannungsfühler (rot) mit positiv und negativ geladenen Aminosäuren; zyklische Nukleotid-Bindedomäne (orange).
References
[1] Windler, F., Bönigk, W., Körschen, H.G., Grahn, E., Strünker, T., Seifert, R., Kaupp, U.B. (2018) "The solute carrier SLC9C1 is a Na+/H+-exchanger gated by an S4-type voltage-sensor and cyclic-nucleotide binding", Nature Communications, 9, 2809.
[2] Gauss, R., Seifert, R. & Kaupp, U.B. (1998) "Molecular identification of a hyperpolarization-activated channel in sea urchin sperm" Nature 393, 583-587.