Bonn, 05.11.2018. Kaum ein Vorgang im Körper ist komplexer als das Zusammenspiel der Nervenzellen im Gehirn. Die verschlungenen Schaltkreise, welche für das Verhalten von Lebewesen verantwortlich sind, lassen sich oft nur schwer identifizieren oder von anderen funktionellen Zellpopulationen abgrenzen. Seit einigen Jahren ist klar, dass sich die Funktion von Nervenzellen in einem Netzwerk besonders gut untersuchen lässt, wenn man Zellen gezielt aktivieren oder ausschalten kann. Für das gezielte Aktivieren von Nervenzellen existieren bereits gentechnische „Werkzeuge“, die mit Hilfe eines Lichtstrahles die Zellen aktivieren. Nun ist es einer Forschergruppe unter wesentlicher Beteiligung von Dr. Reinhard Seifert (caesar) gelungen, einzelne Nervenzellen, ebenfalls mit Hilfe von Licht, selektiv auch auszuschalten. Das neue Werkzeug, welches im Forschungszentrum caesar entwickelt wurde, besteht im Wesentlichen aus zwei Einheiten: einem Photorezeptor, welcher blaues Licht absorbiert und daraufhin einen Botenstoff bildet, sowie einem Ionenkanal, der in Folge durch den Botenstoff geöffnet wird. Das Besondere daran ist, dass der Ionenkanal Kalium transportiert und Zellen zur Ruhe bringt, ein Mechanismus, der auch in der natürlichen Zellsteuerung verwendet wird. So wird die Kontrolle über ein weites Spektrum unterschiedlicher Nervenzellen ermöglicht.
Der Ausschaltimpuls erfolgt über einen kurzen Blaulichtblitz, der auf das Gewebe gerichtet wird. Er sorgt dafür, dass die Zelle für mehrere Minuten in einen Ruhezustand versetzt wird.Bemerkenswert ist die hohe Lichtempfindlichkeit des Rezeptors. Bereits wenige Photonen genügen, um den Effekt auszulösen. So lassen sich Zellen gezielt steuern und unerwünschte Nebeneffekte reduzieren. Wichtig ist auch die Reversibilität des „Eingriffs“. Die Zellen kehren nach einiger Zeit in ihren Normalzustand zurück, ohne dass eine Wirkung zurückbleibt. Den Forschern gelang es, dieses Werkzeug neben Nervenzellen auch in Herzzellen einzubauen.
Für die Erforschung neuraler Netzwerke ist das gezielte Aus- und Anschalten einzelner Zellen ein großer Vorteil. So lässt sich feststellen, welche Rollen einzelne Zellen im größeren Gefüge der Neuronen bzw. im Gehirn spielen. Deutlich wird auch, welche Auswirkungen der Verlust einzelner Zellen auf das Verhalten haben kann.
Die Forschungsarbeit entstand unter Beteiligung von Forschern der Humboldt-Universität zu Berlin, des Deutschen Zentrums für Neurodegenerative Erkrankungen in Berlin, der Charité Universitätsmedizin Berlin, der Universität Bonn und des caesar (Center of advanced european studies and research), der Universität Freiburg sowie des Max-Planck Instituts für Neurobiologie in Martinsried.
Originalpublikation:
Bernal Sierra, Yinth Andrea, Benjamin R. Rost, Martin Pofahl, António Miguel Fernandes, Ramona A. Kopton, Sylvain Moser, Dominik Holtkamp, Nicola Masala, Prateep Beed, John J. Tukker, Silvia Oldani, Wolfgang Bönigk, Peter Kohl, Herwig Baier, Franziska Schneider-Warme, Peter Hegemann, Heinz Beck, Reinhard Seifert, and Dietmar Schmitz. "Potassium Channel-Based Optogenetic Silencing." Nat Commun 9, no. 1 (2018/11/05 2018): 4611. http://dx.doi.org/10.1038/s41467-018-07038-8.
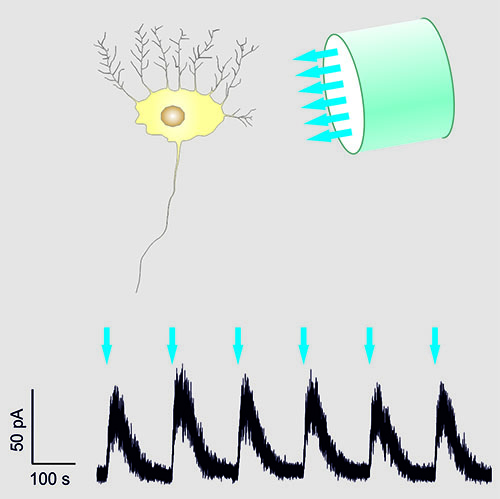
Abbildung: Ein Photorezeptor wurde in eine Zelle eingebracht, um die neuronale Aktivität über einen Lichtstrahl ausschalten zu können. (Foto: R. Seifert / caesar)
Wissenschaftlicher Kontakt: Dr. Reinhard Seifert (E-Mail: Reinhard.Seifert@caesar.de)
Pressekontakt: Sebastian Scherrer (Tel.: +49 228/9656-139 / E-Mail: sebastian.scherrer@caesar.de)
Ăśber das Forschungszentrum caesar
Das Center of Advanced European Studies and Research (caesar) ist ein Forschungsinstitut in Bonn, das Grundlagenforschung auf dem Gebiet der Neuroethologie betreibt und die neuronalen Mechanismen untersucht, die Tierverhalten zugrunde liegen. Das Institut wird durch eine gemeinnützige Stiftung privaten Rechts finanziert. Stifter sind die Bundesrepublik Deutschland und das Land Nordrhein-Westfalen. caesar ist eng mit der Max-Planck-Gesellschaft (MPG) assoziiert und teilt deren wissenschaftliche Prinzipien. Der Präsident der MPG ist Vorsitzender des Stiftungsrates, die caesar-Direktoren sind wissenschaftliche Mitglieder der MPG.







